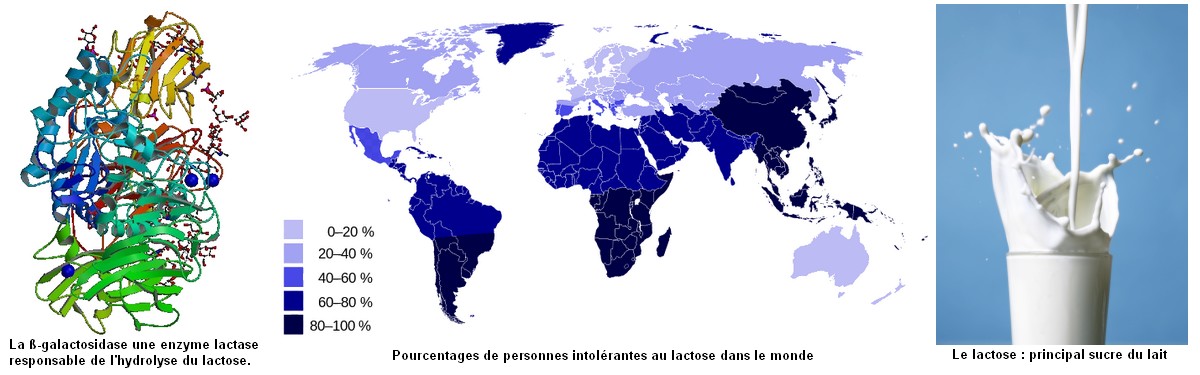
CORPS
HUMAIN ET SANTE : GLYCEMIE ET DIABETE |
|---|

Source : http://fr.wikipedia.org/wiki/Intol%C3%A9rance_au_lactose
I- Définition d'une enzyme
1- L'hydrolyse de l'amidon
TP : Comparaison de l'efficacité d'un catalyseur chimique et d'un catalyseur biologique dans une réaction d'hydrolyse de l'amidon
La plupart des réactions chimiques se déroulant dans une cellule
nécessitent l’intervention d’un catalyseur, molécule
chargée d’accélérer les réactions sans subir
elle-même de modification. Il existe deux catégories de catalyseurs
:
- les catalyseurs chimiques. ex : HCl (acide chlorhydrique)
- les catalyseurs biologiques, protéines appelées enzymes. ex
: amylase pancréatique
L’objectif de ce TP est de réaliser des réactions d’hydrolyse
de l’empois d’amidon (amidon cuit) pour tester les deux types de
catalyseurs. Le protocole doit être rigoureusement respecté et
les résultats consignés soigneusement dans des tableaux que vous
devrez construire. Le travail sera effectué en groupe en partageant intelligemment
les tâches.
I- Hydrolyse de l’amidon en présence d’un catalyseur chimique
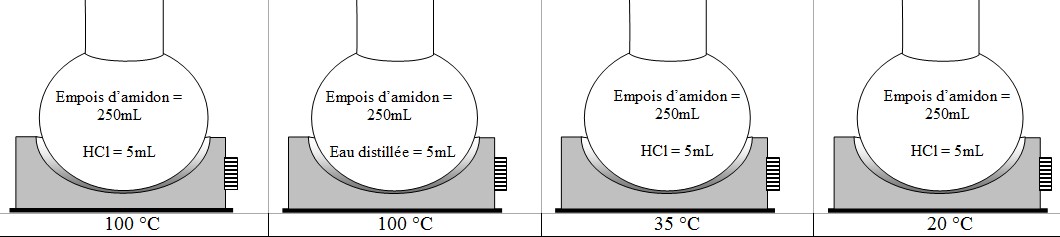
1) Préparez les 4 montages comme cela est décrit
dans le schéma ci-dessus.
2) Réglez les chauffe-ballon de manière à avoir la température
constante souhaitée.
3) Effectuez un prélèvement de 5mL dans chaque ballon toutes les
10 minutes pendant 1 heure.
- testez vos prélèvements à l’eau iodée (après
avoir refroidi sous l’eau du robinet chaque tube)
Résultats des tests à l'eau
iodée : |
|
Amidon + HCL à 100°C |
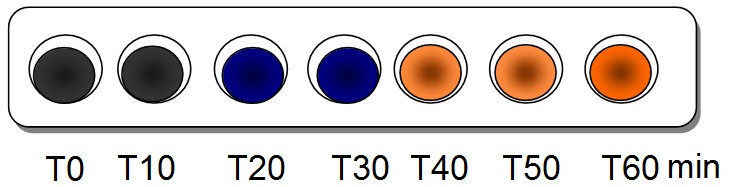 |
Amidon + eau distillée à 100°C |
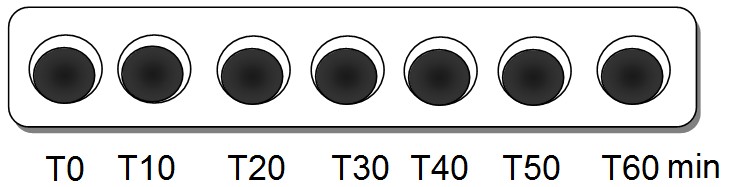 |
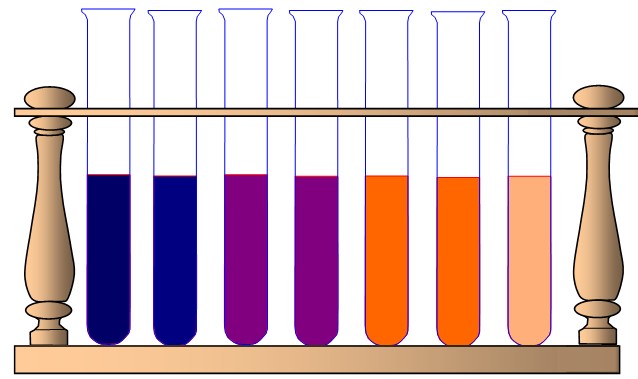
Amidon + HCl à 35°C |
 |
Amidon + HCL à 20°C |
 |
- testez les prélèvements à la liqueur de fehling (le chauffage n’est pas nécessaire pour les tubes provenant des ballons à 100°C, en revanche, pensez à neutraliser l’acide chlorhydrique en ajoutant quelques gouttes de soude).
Résultats des tests à la
liqueur de Fehling : |
|
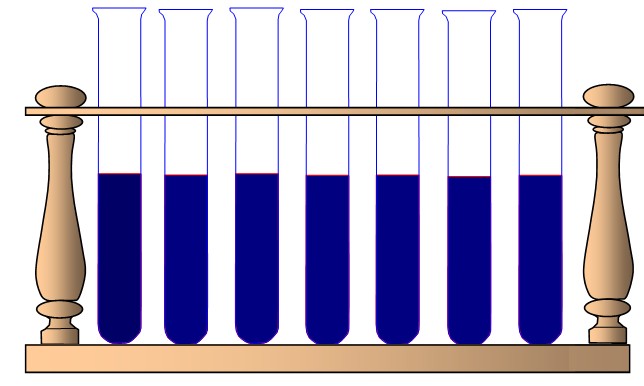
Amidon + HCL à 100°C |
 |
Amidon + eau distillée à
100°C |
 |
Amidon + HCl à 35°C |
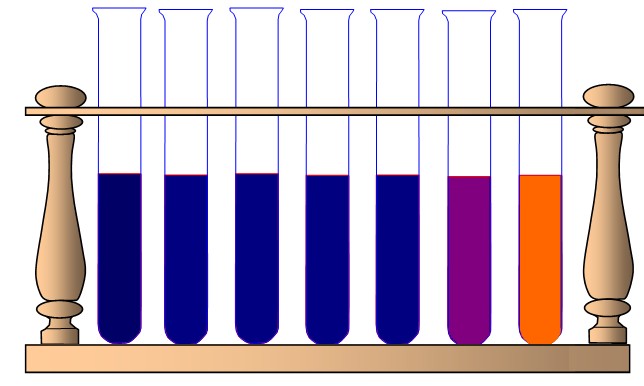 |
Amidon + HCL à 20°C |
 |
En tableau :
T0 |
T10 |
T20 |
T30 |
T40 |
T50 |
T60 |
||||||||
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
|
| Amidon + HCL à 100°C | + |
- |
+ |
- |
+/- |
-/+ |
+/- |
-/+ |
- |
+ |
- |
+ |
- |
+ |
| Amidon + eau distillée à 100°C | + |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
| Amidon + HCL à 35°C | + |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
+/- |
-/+ |
- |
+ |
| Amidon + HCL à 20°C | + |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
Conclusion :
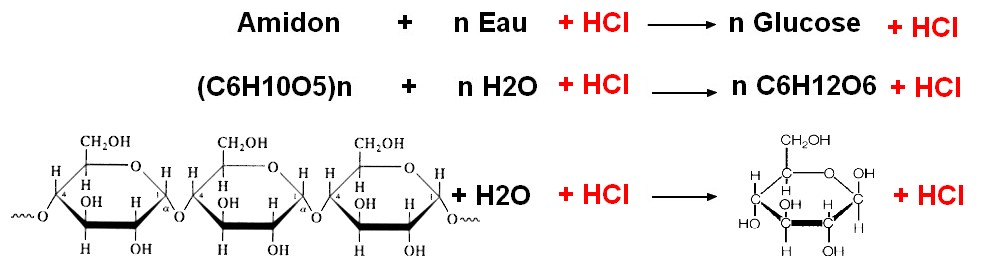
Même à 100°C, la molécule d'amidon n'est pas hydrolysée (détruite par l'eau) au bout d'une heure. En revanche, la présence d'HCl permet d'obtenir dans les mêmes conditions, une réaction au bout de seulement 20 minutes : c'est un catalyseur. Son action semble dépendre de la température de la réaction. Le test à la liqueur de Fehling permet de mettre en évidence les produits de cette réaction : des sucres réducteurs (maltose et glucose).
Equation de la réaction par la catalyse chimique :
II- Hydrolyse de l’amidon en présence d’un catalyseur biologique
1) Dissoudre une pincée de pancréatine dans 100mL d’eau
distillée.
2) Filtrez et ajoutez 1mL de CaCl2 pour 5mL de filtrat.
3) Délayez 10g de poudre de germe de blé dans 100mL de tampon
(pH ~ 5.3).
4) Filtrez et ajoutez 1mL de CaCl2 pour 5mL de filtrat.
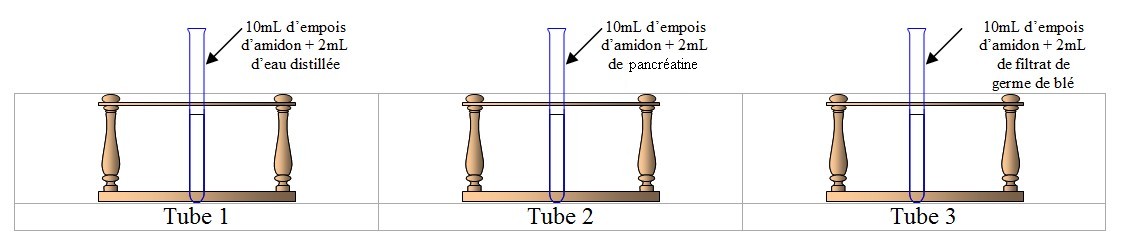
5) Préparez les 3 tubes suivants et placez-les au bain marie à
37°C (~ température du corps) :
6) Prélevez 1mL dans chaque tube toutes les 2 minutes.
- testez vos prélèvements à l’eau iodée.
- Si le test à l’eau iodée est négatif, testez les
prélèvements à la liqueur de fehling.
NB : Pour le test à la liqueur de fehling, neutralisez l’acide
chlorhydrique en ajoutant quelques gouttes de soude (NaOH). N’oubliez
pas les témoins !
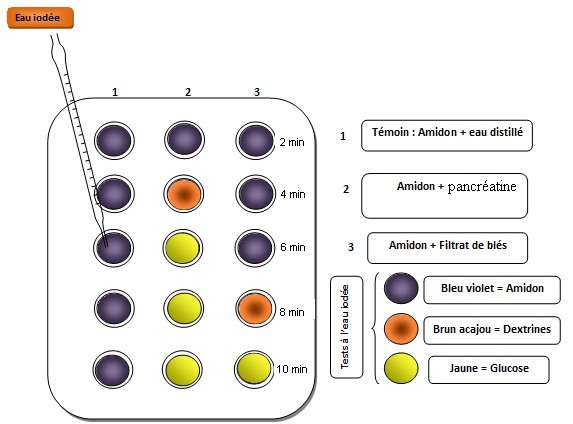
NB : les dextrines sont des composés intermédiaires
T0 |
T2 |
T4 |
T6 |
T8 |
T10 |
|||||||
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
eau iodée |
liq. de F |
|
| Amidon + Eau distillée à 37°C | + |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
| Amidon + Maxilase à 37°C | + |
- |
+ |
- |
-/+ |
+/- |
- |
+ |
- |
+ |
- |
+ |
| Amidon + Filtrat de blés à 37°C | + |
- |
+ |
- |
+ |
- |
+ |
- |
-/+ |
+/- |
- |
+ |
Conclusion :
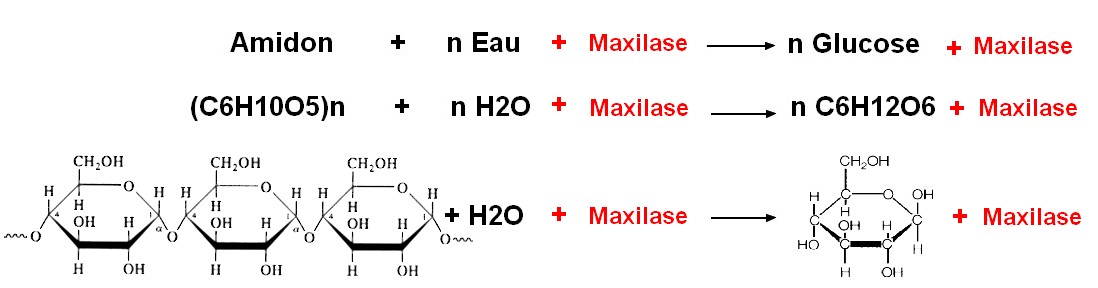
La maxilase permet une hydrolyse assez rapide de l'amidon : la réaction commence au bout de 4 minutes seulement et à une température beaucoup plus basse que l'hydrolyse en milieu acide : un catalyseur biologique est très efficace.
Les germes de blé contiennent une enzyme capable d'hydrolyser l'amidon à 37°C.
Equation de la réaction par la catalyse biologique :
Remarque 1 : le nom des enzymes portent un suffixe en -ase : amylase, lactase...
Remarque 2 : certains ARN ont une activité enzymatique. On les appelle des ribozymes. Ils sont chargés de catalyser la formation de la liaison peptidique entre les différents acides aminés des protéines au cours de la traduction dans le cytoplasme.
2- Mécanisme d'action d'une enzyme
Activité : Livre p22-23 + exo 1 p36
TP : synthèse et stockage de l'amidon dans le tubercule de pomme de terre
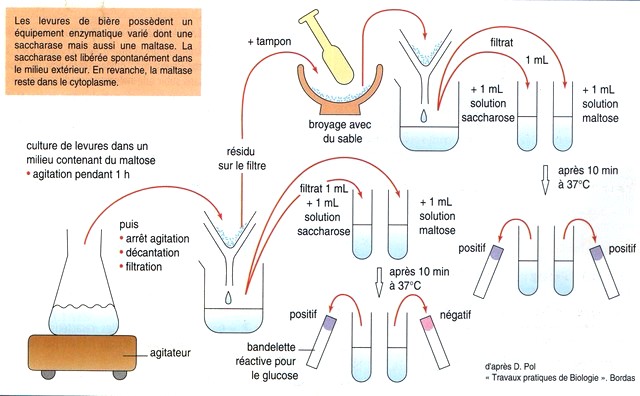
Mise en évidence de la spécificité de substrat
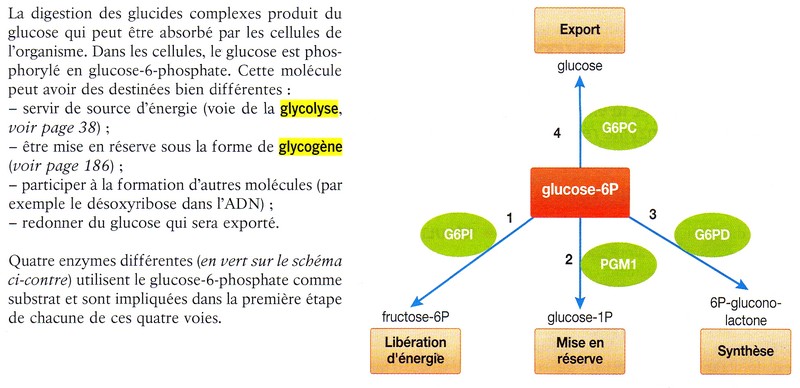
Un exemple de spécificité d'action
Document extrait du manuel de Terminale Spe Bordas 2012 p171
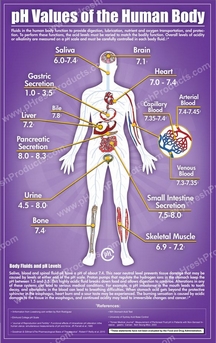

Pb : La digestion in vitro de l'amidon en présence de pancréatine a été réalisée à 37, 5 °C, température moyenne du corps. Mais comme nous le montrent les schémas ci-dessus, la température comme le pH peuvent varier d'un organe à un autre et d'un état à un autre. Les enzymes agissent-elles toutes à la même température et au même pH ou sont-elles adpatées à des conditions particulières en fonction de l'endroit où elles se trouvent par exemple ?
II- Les conditions d'action d'une enzyme
1- Les conditions du milieu
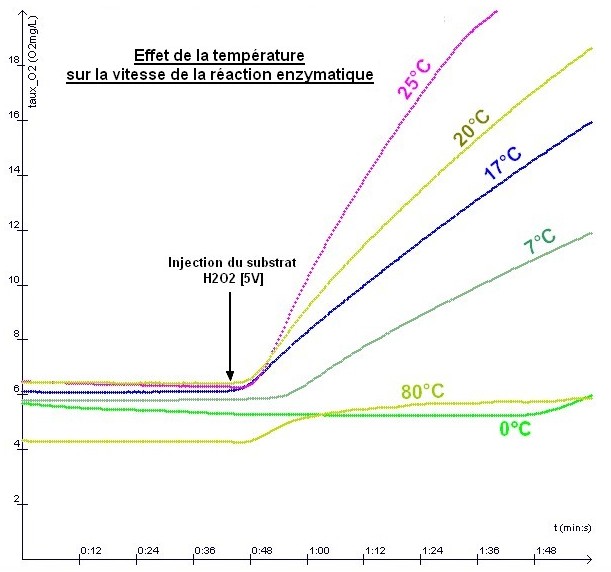
TP13 : Activité enzymatique et paramètres physico-chimiques du milieu
|
 |
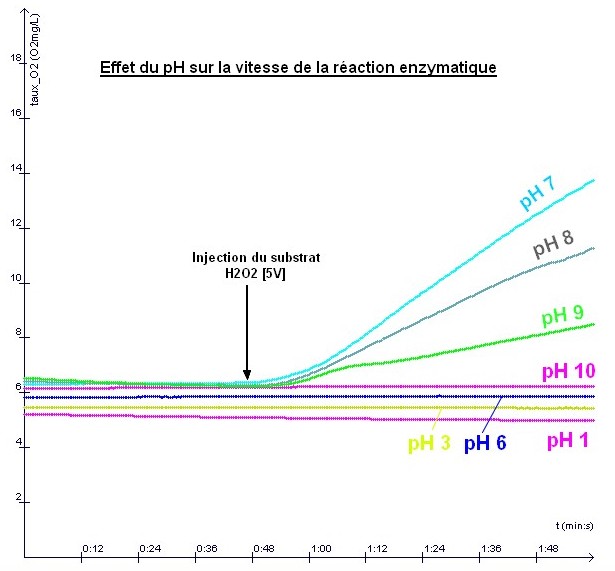 |
Comme pour la température, il existe une pH optimum pour lequel l'enzyme est très active. En dessous ou au dessus de ce pH, l'enzyme devient inactive. Plus
la concentration en substrat augmente, plus la vitesse de la réaction
est grande mais au dela d'une certaine concentration, l'enzyme ne "travaille"
pas plus vite. |
Pb : Pourquoi ces facteurs sont-ils si importants pour le bon déroulement de la réaction enzymatique ?
2- La forme de l'enzyme
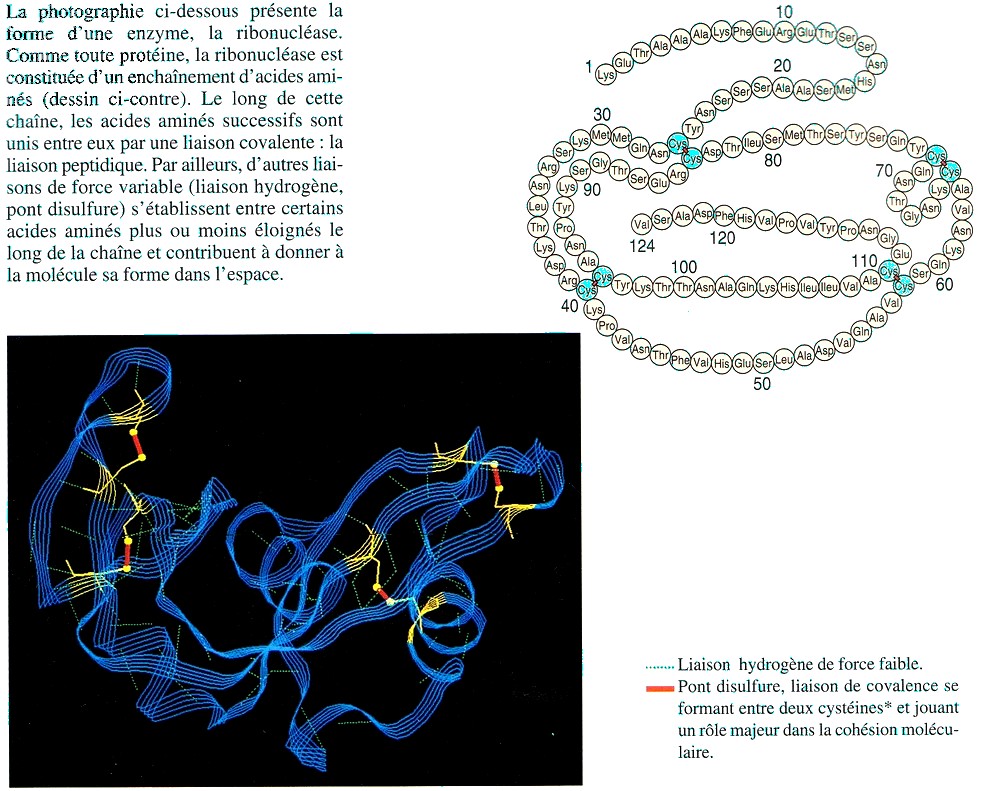
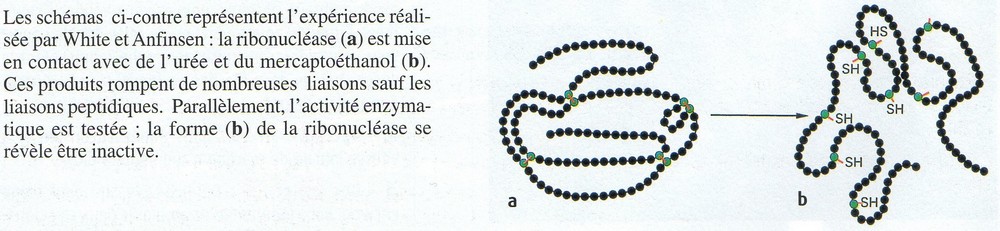
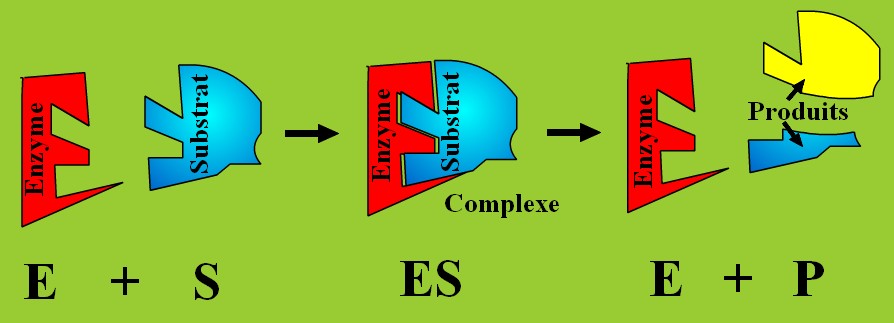
Lien source : http://www.geniebio.ac-aix-marseille.fr/bioch/bioch.html
Remarque : Ce modèle clé-serrure est un peu simpliste. Les chercheurs ont découvert que le site de reconnaissance change très légèrement de forme pour s'ajuster au substrat. C'est le "induced fit model"
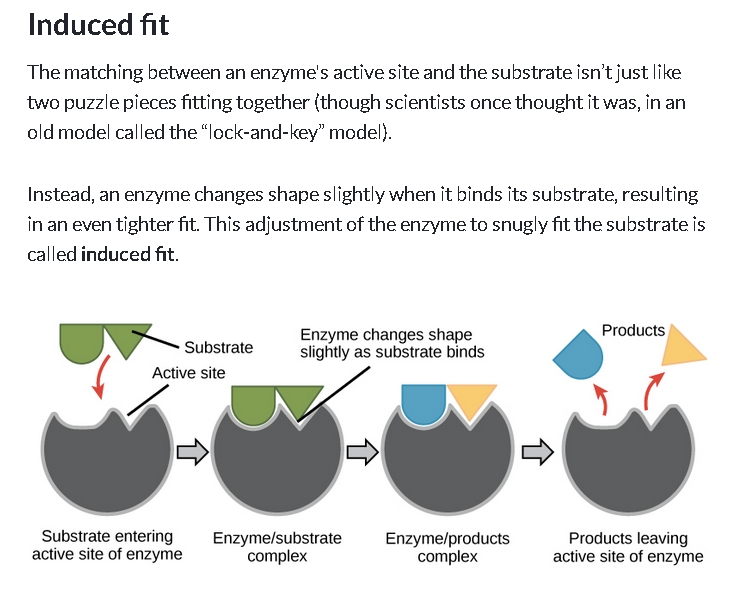
BILAN
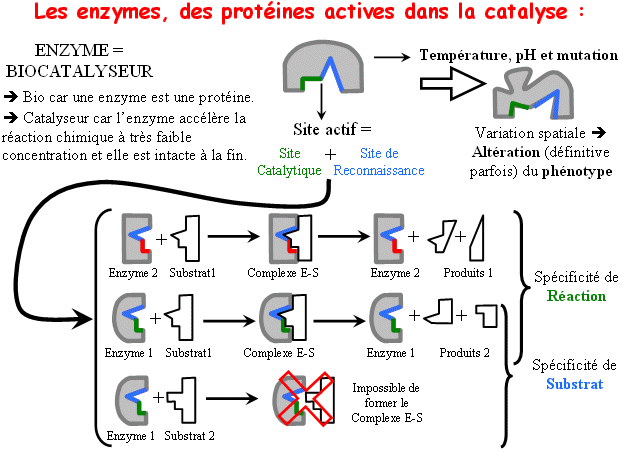
Source : http://www.ac-grenoble.fr/svt/log/1_s/images/enzym_specif.gif
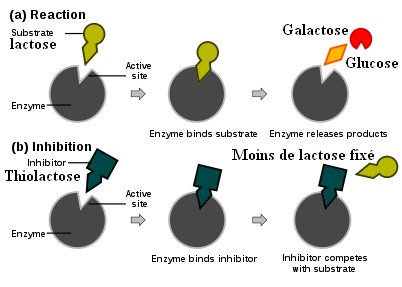
Illustration de l'inhibition compétitive (ex : lactose vs thiolactose)
Un excellent site pour approfondir ses connaissances : http://www.cegep-ste-foy.qc.ca/profs/gbourbonnais/pascal/fya/chimcell/notesmolecules/proteines_4.htm